熊本大学は6月13日、ゲノム編集分子「Cas9 RNP」を高効率で細胞内に導入することを目的として、同大学が開発した運び屋(キャリア)「変幻自在ポリマー」がその変幻自在特性により、siRNA、アンチセンス核酸、タンパク質、メッセンジャーRNA、Cas12a(Cpf1)RNPなどのさまざまなバイオ化合物に対しても強く相互作用し、最高水準で細胞内に導入可能なことを明らかにしたと発表した。
核酸やゲノム編集分子が効果を発揮するためには、細胞内にそれらを導入する必要があるが、細胞内への導入は容易ではなく、実際にはほとんど導入できないことが課題となっている。また、タンパク質や抗体は細胞外で効果を示すものが多いが、それらを細胞内に効率よく導入することができれば、創薬のターゲットが広がり、新たな機序の医薬品を創り出せるとして期待されている。つまり、昨今の医薬品開発において、バイオ化合物を高効率に細胞内に導入するためのキャリアの開発が非常に重要であり、高性能のキャリアを実現できれば、バイオ化合物を用いた医薬品開発が加速すると考えられる。
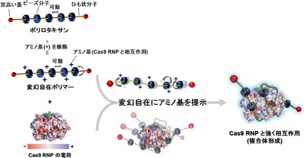
研究チームが2022年に発表したのが、Cas9 RNPの形や細胞内の環境を認知して多段階に変形し、同分子を高効率に細胞内に導入できる変幻自在ポリマー。ポリロタキサン中のビーズ分子は、ひも状分子鎖に沿って動くことができるため、ビーズ分子に、Cas9 RNPと相互作用可能な官能基を導入すると、Cas9 RNPの形や電荷分布に合わせて変幻自在に変形し、オンデマンドに官能基を提示することで、強く相互作用することができるというメカニズムだ。
変幻自在ポリマーとCas9 RNPの複合体が細胞内に取り込まれると、Cas9 RNPを分解してしまう小胞のエンドソームを速やかに脱出し、その後に細胞質でCas9 RNPを放出することが可能となる。そして、市販の最高水準のキャリアと比較しても導入効率に優れ、しかも安全性に優れることが確認されたという。
近年、次々に新しいバイオ化合物が誕生しているものの、バイオ化合物のキャリアを構築する際には、一般にバイオ化合物ごとに適したキャリアを設計する必要があった。これは非常に時間や労力を要するため、あらゆるバイオ化合物に対して高い細胞内導入効率を示すキャリアの開発が切望されていたという。変幻自在ポリマーは上記の課題解決に一石を投じる可能性があり、平時のみならずパンデミックのような緊急時など、特に迅速に医薬品開発が必要とされる状況にも役立つことが考えられるとしている。